
국내 최초의 항암 신약이 FDA 승인되어 화제이다.
유한양행의 ‘렉라자’ (성분명 : 레이저티닙)이다. 한국에서 처음으로 FDA 승인을 받은 신약은 2003년에 LG화학이 만든 ‘팩티브’라는 약이며, 렉라자는 한국 신약 중 처음으로 FDA 승인을 받은 항암제로 기록되었다.
유한양행은 J&J로부터 약 800억 원 규모의 마일스톤(단계별 기술료)을 수령하게 되며, 리브리반트와 렉라자가 세계 폐암 치료제 시장의 70%를 차지할 것으로 예상됨에 따라 유한양행이 받을 연간 로열티만 3,000억 원을 웃돌 것으로 추산하고 있다고 한다. 연간 매출 1조원을 달성하는 K-블록버스터 의약으로 기대되는 이유이다.
렉라자는 뇌 침투가 가능한 3세대 경구투여용 EGFR 티로신 키나제 억제제(TKI) 이다. 렉라자는 얀센의 리브리반트(성분명 : 아미반타맙)와 병용요법의 1차 치료제로서 승인되었다. 리브리반트 최근 Label 에는 EGFR 엑손 19 결실 또는 엑손 21 L858R 돌연변이 NSCLC(비소세포폐암) 성인 환자의 1차 치료로, 리브리반트와 렉라자를 병용하여 사용되는 것으로 기재되었다.
렉라자는 EGFR 양성 비소세포폐암 중 엑손 19, 엑손 21(L858R)을 타깃하며, 리브리반트는 엑손 20, MET 변이를 타깃하는 표적치료제이다. 리브리반트는 2021년 5월 FDA는 성인 비소세포폐암(NSCLC) 환자 중 EGFR 엑손 20 삽입 돌연변이를 가진, 이전에 백금 기반 화학요법을 받은 적이 있는 환자들을 치료하기 위한 단독 요법으로 승인받은 바 있다.
렉라자의 특허 보호
그렇다면, K-블록버스터 의약으로 기대되는 국내 1호 항암 신약은 특허로서 잘 보호되고 있을지 궁금하여 관련 특허를 검토해 보았다. 신약의 임상 기간으로 약 10년을 잡으므로, 판매 허가 이후에는 경우에 따라 특허권의 존속기간(출원일부터 20년)이 얼마 남아있지 않은 경우도 존재할 수 있기 때문이다.
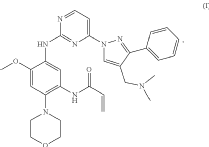
렉라자 특허를 확인해 보니, 2015년 레이저티닙 소분자 화합물 자체에 대한 특허(WO2016-060443 등), 2018년 레이저티닙 결정형 특허, 2019년 경구 투여용 제형 특허를 출원하여 계속 중인 것으로 확인된다. 적어도 2035년 이후에 만료되며, 존속기간 연장신청이 있는 경우 더 연장되며, 경구용 제형에 대해서는 특허로서 독점기간이 연장될 수 있게 되어 있었다.
병용요법에 대한 미국 특허
병용투여에 대해서는 누가 권리를 갖고 있을지 또 궁금하여 확인해 봤다. 미국 특허는 유한양행과, 얀센이 공동 출원인으로서 출원 계속 중임을 확인하였고, 여기에 청구항(권리)을 간략히 소개헤 보겠다.
1. A method of treating a subject having an EGFR or c-Met expressing cancer, comprising administering to the subject a combination therapy, wherein the combination therapy comprises a therapeutically effective amount of an isolated bispecific anti-epidermal growth factor receptor (EGFR)/hepatocyte growth factor receptor (c-Met) antibody and a therapeutically effective amount of a compound of formula (I)
or solvate, hydrate, tautomer, or a pharmaceutically acceptable salt thereof.
* 주 : Formula (I)이 레이저티닙이다.
신약 개발에서 특허의 중요성과 기업들의 전략
신약 개발기업들은 긴 임상 기간을 고려해, 허가 이후에도 존속할 수 있는 독점권을 갖기 위해, R&D를 지속하고, 권리를 창출하고 있다. 대기업뿐만 아니라 스타트업에서도 그 필요성은 잘 알고 있다고 생각되지만, 본 사례도 기업의 특허 포트폴리오에 참조될 수 있을 것으로 생각된다.
원문 : K-항암 신약 ‘렉라자’, FDA 승인과 특허 현황
저자소개 : 박연수 BLT 파트너 변리사는 생명공학, 약학 및 화학 분야 국내 및 해외 기업의 특허 업무 전반에 대하여 전문성을 가지고 업무를 수행해 왔으며, 국내 바이오 기업에서 IP 전략 수립, 국내외 IP 소송 업무를 담당하였습니다. 현재, 화학 바이오 분야 특허출원 업무 및 지식재산권 전반에 걸쳐 다루어지는 분쟁, 소송에 대한 대응, 자문 업무를 담당하고 있습니다.






댓글 남기기